¡Hola!
¿Cómo estás? Espero que estés animad@ y avanzando poco a poco hacia tus objetivos. Hoy vamos a seguir con el tema de cinética química. Más concretamente, vamos a estudiar cuáles son los factores que influyen en la velocidad de reacción.
La explicación se divide en los siguientes puntos:
- Naturaleza química del proceso
- Estado físico de los reactivos
- Concentración de los reactivos y presión
- Temperatura
- Catalizadores
- Ejercicios resueltos
La velocidad de reacción se ve influenciada por los siguientes factores:
Naturaleza química del proceso
Las reacciones que implican ruptura y formación de nuevos enlaces covalentes son más lentas, Sobretodo si los enlaces son múltiples. Por otro lado, las reacciones de transferencia de electrones
(redox) suelen ser rápidas ya que solo implica un intercambio de electrones, sin la ruptura de enlaces.
Estado físico de los reactivos
Para que se dé una reacción química es necesario que se produzca el choque de las moléculas. Por ello, todos los factores que favorecen la movilidad de las moléculas aumentan la velocidad de reacción. Así, las reacciones con reactivos sólidos transcurren lentamente pero si están disueltas o en estado gaseoso la reacción es más rápida.
Además, las reacciones homogéneas, es decir, las reacciones en las que todos los reactivos están en la misma fase, son más rápidas. Sobretodo, si se encuentran en estado gaseoso. Sin embargo, las reacciones heterogéneas (los reactivos están en fases diferentes) son más lentas que las homogéneas ya que depende de la superficie de contacto entre las fases.
Concentración de los reactivos y presión
De acuerdo con la teoría de colisiones (la veremos en el próximo post) para que se produzca una reacción química es necesario que choquen entre sí las moléculas de los reactivos. El número de choques será proporcional a la concentración de cada uno de los reactivos. De esta forma, y como se puede observar en la ecuación de velocidad, la velocidad es proporcional a la concentración los reactivos elevadas a sus órdenes parciales.
v=k [ A]α [B]β
Cuando se trata de una reacción entre gases, el aumento de la presión aumenta el número de moléculas. De esta forma, si aumentamos la presión aumentaremos los choques entre las moléculas y con ello la velocidad de reacción.
En aquellas reacciones donde se aplica un exceso de reactivo, aunque no se consiga aumentar la cantidad total de producto, se consigue un aumento de velocidad al haber una mayor concentración de reactivo.
Temperatura
La velocidad de todas las reacciones químicas aumenta al elevar la temperatura. Este efecto puede explicarse a partir de la teoría de colisiones (la explicaremos en el siguiente post), ya que al aumentar la temperatura aumenta la energía cinética media de las moléculas y con ello el número de choques.
El aumento de la energía cinética de las moléculas conlleva además un mayor número de moléculas que, en el choque, superan la barrera energética que supone la energía de activación, con lo que aumenta considerablemente la velocidad de reacción.
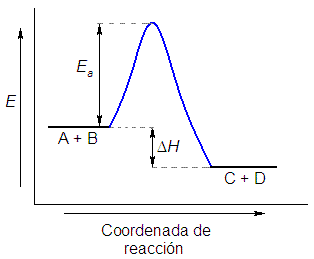
Para la reacción A+B→ C+D, el siguiente gráfico presenta cómo varía la energía durante el transcurso de la reacción. Se puede ver que:
- Ea sería la energía de activación, energía que deben de adquirir los reactivos para poder transformarse en los productos
- ΔH es el incremento de entalpía de la reacción, energía que se desprende o se absorbe durante la reacción.
De acuerdo con la ecuación de Arrhenius al elevarse la temperatura aumenta el valor de la constante de velocidad, lo que conlleva el aumento de la velocidad de reacción.
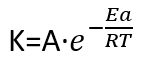
Donde A es un factor preexponencial (factor de frecuencia), Ea es la energía de activación (energía necesaria para que se dé la reacción), R es la constante de los gases ideales y T es la temperatura.
Como se puede ver por el signo asociado al exponente -Ea/RT, un aumento de la temperatura da lugar a un aumento de K. Provocando un aumento de la velocidad de reacción.
Catalizadores
Un catalizador es una sustancia que, incluso en cantidades muy pequeñas, modifica mucho la
velocidad de una reacción, sin sufrir ella misma ninguna alteración química permanente. Este
fenómeno se denomina catálisis.
El catalizador no se consume en la reacción pero tiene un papel activo en la misma, ya
que cambia el mecanismo de la reacción, proporcionando un mecanismo de reacción cuya
energía de activación es menor.
Según la ecuación de Arrhenius: ![]()
si Ea es menor → el exponente de la ecuación es menor→ K es mayor → la velocidad es mayor
El siguiente gráfico representa la energía durante el transcurso de la reacción X→Y.
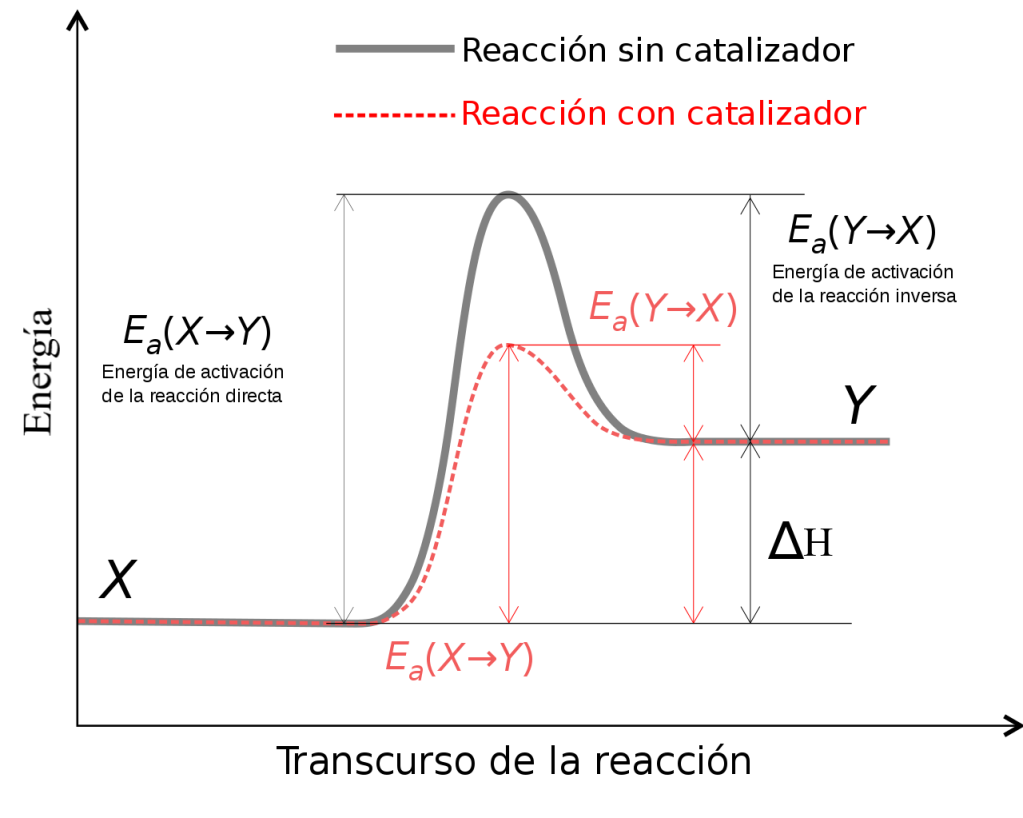
Cuando un catalizador se encuentra en la misma fase que los reactivos, se habla de catálisis
homogénea. Y cuando se encuentra en una fase diferente se trata de una catálisis heterogénea.
Ejercicios Resueltos
1. Considerando el diagrama de energía que se muestra, para la reacción: A → B + C conteste razonadamente a las siguientes preguntas:
a) ¿Cuál puede ser la causa de la diferencia entre la curva 1 y la 2?.
b) ¿Para cuál de las dos curvas la reacción transcurre a mayor velocidad?.
c) ¿Qué le sucederá a las constantes de velocidad de reacción si se aumenta la temperatura?.

a) La diferencia entre la curva 1 y 2 es la energía de activación, la curva 1 presenta una energía de activación mayor la curva 2. Esto puede ser debido a que en la curva 2 se ha empleado un catalizador, lo cual provoca que la energía de activación disminuya.
b) La velocidad será mayor para la curva 2, ya que la energía de activación es menor. Según la ecuación de Arrhenius, al disminuir la Ea aumenta la K y se aumenta la velocidad.
c) Según la ecuación de Arrhenius:
si la T aumenta→ el exponente de la ecuación disminuye→K aumenta→ V aumenta
2. La reacción en fase gaseosa: 2 A + B → 3 C es una reacción elemental
a) Formule la expresión para la ecuación de velocidad.
b) Indique las unidades de la velocidad de reacción y de la constante cinética.
c) Justifique cómo afecta a la velocidad de reacción un aumento de la presión.
d) Justifique cómo afecta a la velocidad de reacción un aumento del volumen a temperatura constante.
a) V= K [A]2 [B] Al ser una reacción elemental, los coeficientes estequiométricos coinciden con los órdenes parciales de cada reacctivo.
b) Unidades de la velocidad: mol/(L·s)
Unidades de la K: V= K [A]2 [B]→ mol/(L·s)= K (mol/L)2 → K=mol·L2/mol2 ·L·s= L/(mol·s)
c)En una reacción en fase gaseosa, un aumento de la presión (ó disminución de volumen) provoca que las moléculas de reactivos estén más juntas, lo cual provoca mayor probabilidad de choques, por lo que se aumenta la velocidad de reacción.
d) En una reacción en fase gaseosa, un aumento del volumen (ó disminución de la P) provoca que las moléculas de reactivos estén más separadas, lo cual provoca menor probabilidad de choques, por lo que se disminuye la velocidad de reacción.